呈秉硕生物创新无细胞表达平台,热门靶点Claudin18.2蛋白价格大幅降低,国内医药研发迎来新助力!
胃癌相关性:Claudin 18.2 主要在胃黏膜上皮细胞的紧密连接中表达,并且在正常组织中的表达水平较低。在胃癌、胰腺癌、食管癌和肺癌等多种实体肿瘤中,尤其是胃癌(约60%至80%的病例)和胰腺癌(约50%的病例)中,Claudin 18.2呈现出高表达或过表达现象。
治疗性药物:由于其在肿瘤细胞表面的特定表达,针对 Claudin 18.2 设计的药物能够特异性地识别并结合到这些肿瘤细胞上,从而发挥抗肿瘤效应。例如,Astellas 公司的靶向性抗体 Zolbetuximab 已率先向 FDA 提交上市申请。
机会:当前对于进展期胃癌以及其他 Claudin 18.2 阳性癌症患者的治疗手段有限,尤其是在标准疗法无效或效果不佳的情况下。Claudin 18.2 作为新靶点的发现与相关药物的研发有望填补这一临床治疗空白,为大量患者提供更精准有效的个体化治疗机会。
挑战:长久以来,由于 Claudin18.2 的复杂性和特殊性质,其研究和制备过程异常艰难,导致相关研究成本高、风险高,也成为科研工作者的一大障碍。
”
关于胃癌及治疗性靶点
胃癌作为全球公共卫生的重大挑战,其发病数量与死亡率均位居前列,预计至2035年将有超过1000万新发病例和560万死亡病例出现。在中国,由于庞大的人口基数、特定的生活习惯风险因素(如幽门螺杆菌感染、不良饮食结构、吸烟行为以及既往胃肠道疾病史)以及家族遗传背景的影响,胃癌的发病率及危害尤为突出,占据了全球近半数病例。
胃癌是全球重要的公共卫生问题,位居第四常见癌症及第二大致死癌症。根据一项最新的研究预测,在2021年至2035年间,预计全球将出现1000万新增胃癌病例和560万胃癌死亡病例。在中国,胃癌的主要风险因素包括幽门螺杆菌感染、不良饮食习惯、吸烟、胃肠道疾病史以及家族中曾有胃癌病史。由于庞大的人口基数和较差的生存率,胃癌在中国仍然构成威胁,占据了全球近一半的病例。尽管发病率和死亡率有所下降且在流行病学、病理学、分子机制及治疗方案等方面取得重要进展,但其带来的负担依然沉重。
胃癌按解剖位置分为非贲门部腺癌和贲门-食管结合部腺癌,从组织病理学角度则进一步划分为弥漫型和肠型两种类型。对于局部晚期病例,在实施手术的同时通常会加入辅助或新辅助疗法。然而,一旦发展到转移阶段,胃癌患者的预后极差,中位生存期仅约1年左右。
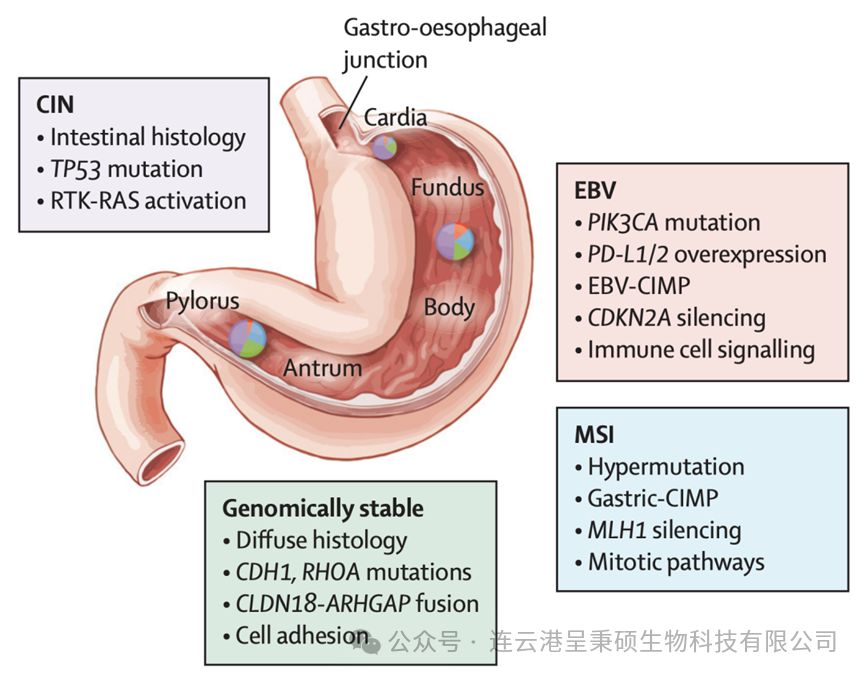
(来源于 DOI: 10.1016/S0140-6736(16)30354-3)
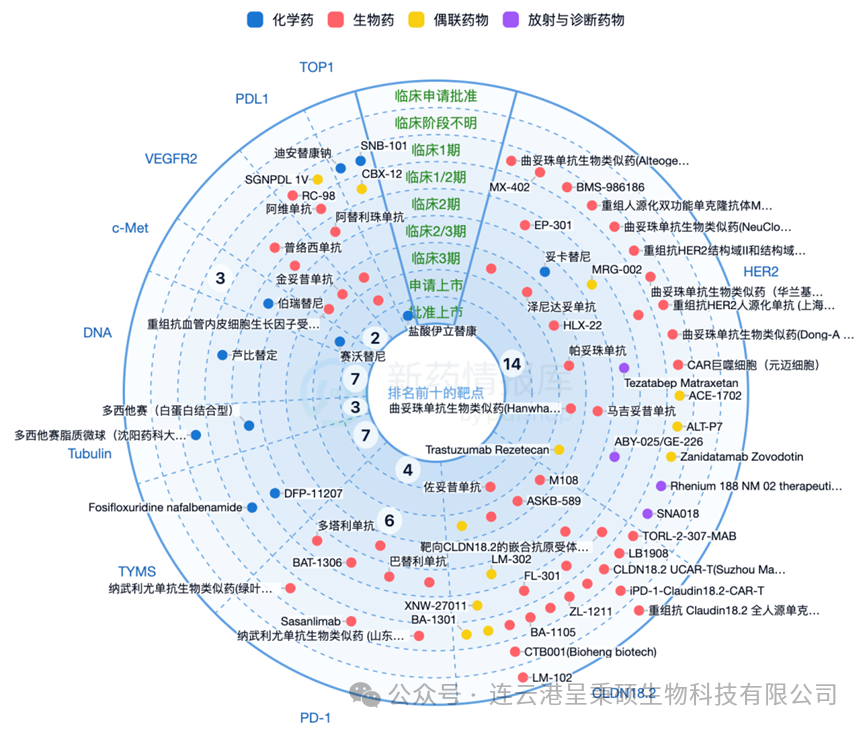
近年来,针对特定分子靶点的靶向疗法已被引入临床实践,例如抗HER2 抗体 trastuzumab 单抗和抗 VEGFR-2 抗体 ramucirumab 单抗等药物。另外,Claudin 18.2 也是一个重要的胃癌治疗靶点,该基因与胃癌发生发展中特定的分子亚型有关,该基因及其相互作用通路作为潜在胃癌治疗靶标,用于开发新型个体化治疗策略。下图为智慧芽新药情报库统计的全球胃癌治疗热门靶点:
关于 Claudin 18.2
Claudin 18.2 (CLDN18.2) 是 Claudin 18 基因通过可变剪接过程产生的一个异构体,属于 Claudin 家族的成员。Claudins 是一类多基因四次跨膜的紧密连接蛋白家族的成员,它们在细胞间的紧密连接中起到关键作用,维持细胞间屏障的完整性,并调控物质的选择性通透。
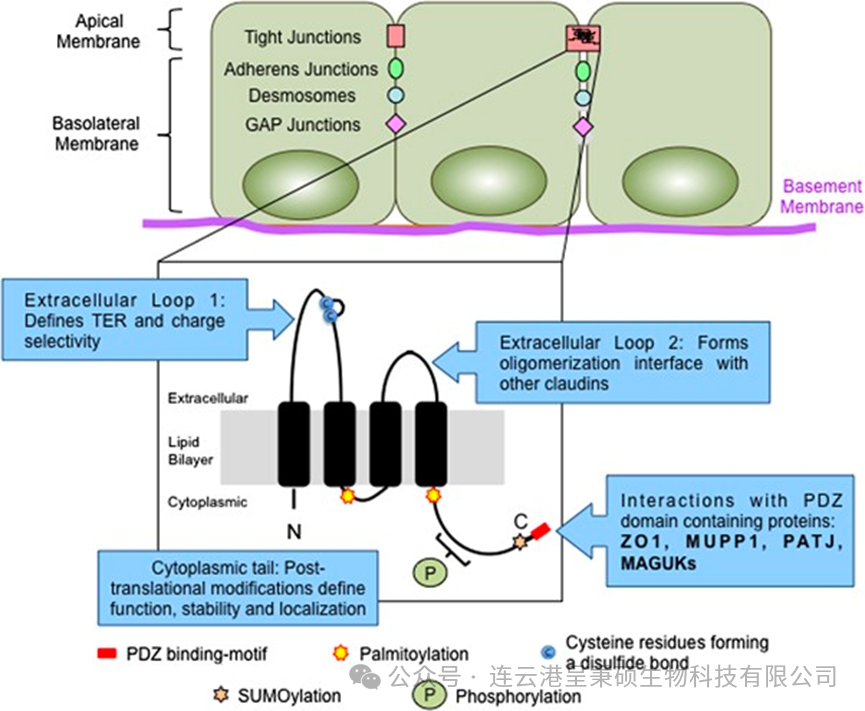
(来源于 DOI: 10.1038/onc.2016.289)
Claudin 18 基因有包括 Claudin 18.1 和 Claudin 18.2 两个异构体 (两者序列 identity 为 91%),分别为肺和胃组织中分布。Claudin 18.2 通常在多种癌症,包括胃癌(GC) 和胰腺癌 (PC) 中表达,除胃黏膜外,Claudin 18.2 在任何健康组织中均无表达。
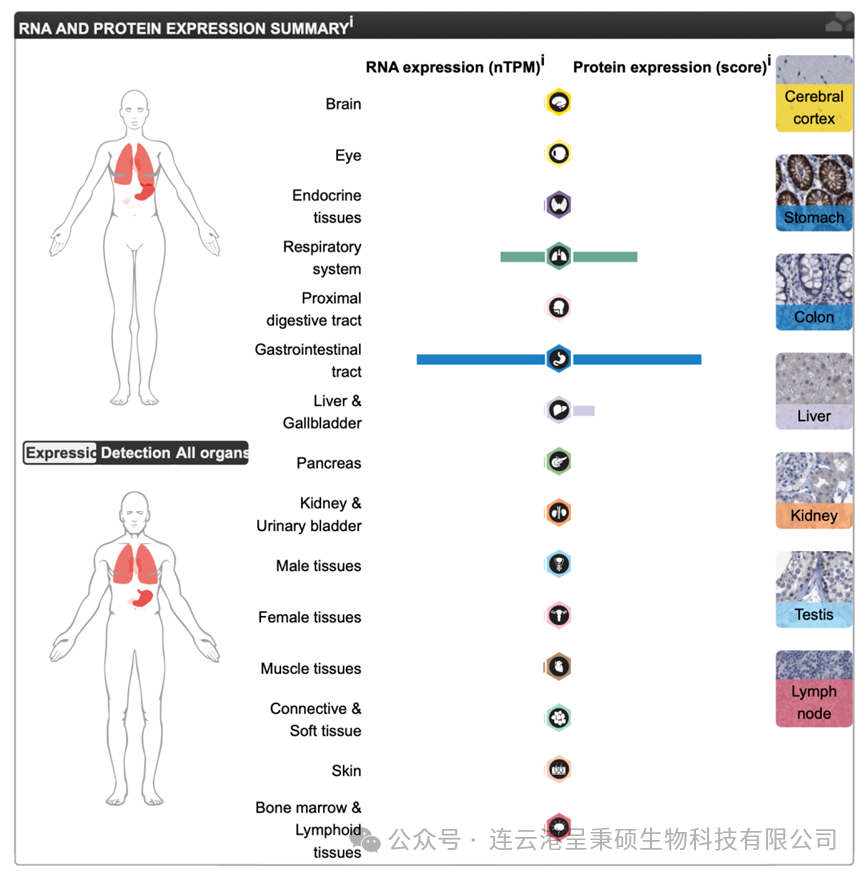
Claudin 18.2 基因、蛋白与功能
人类染色体 3q22 上的 Claudin 18 基因位点大约覆盖 35 kb,该基因由6个外显子和5个内含子组成。该基因具有两个不同的第一外显子(外显子1a和1b),这两个外显子会被转录并进行可变剪接,从而产生两种不同的异构体:Claudin 18.1 和Claudin 18.2,而两种异构体仅在N端末端的序列有所不同。
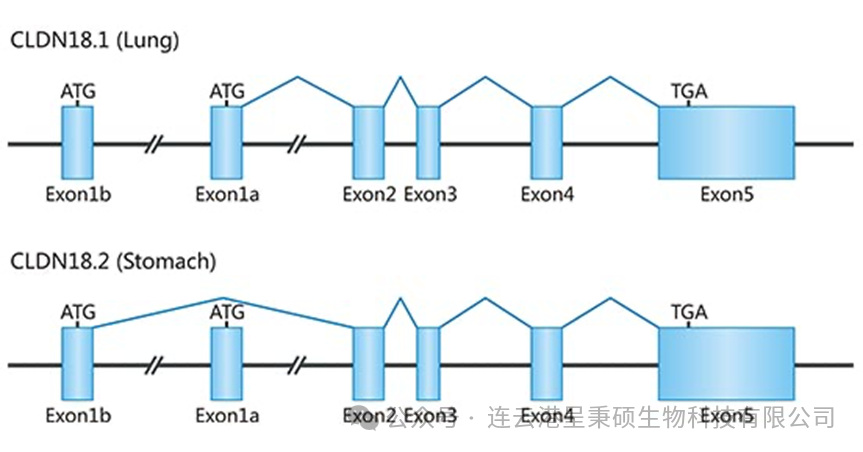
Claudin 18.1 和Claudin 18.2 均由261个氨基酸组成,两者均包含四个跨膜结构域,其氨基端和羧基端位于细胞内,并具有两个胞外环(ECL1、ECL2)。在Claudin 18.1 和Claudin 18.2 的 ECL1 大约50个氨基酸序列中,仅有7个氨基酸残基存在差异。
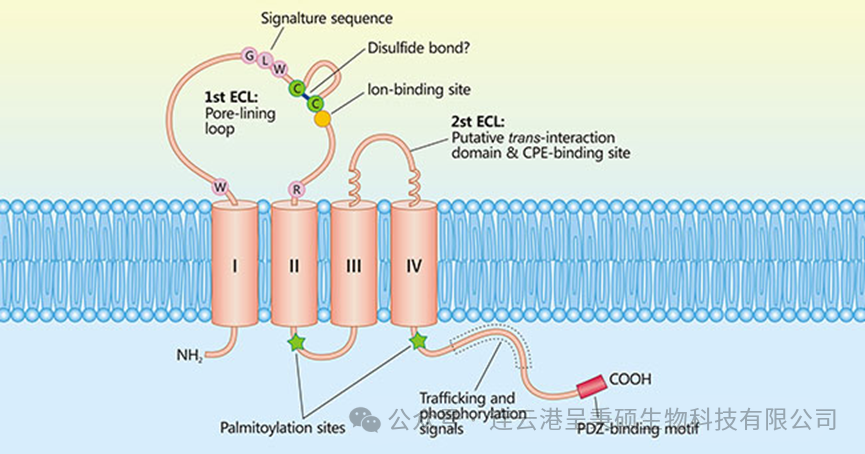
截止目前,人源 Claudin 18 两个异构体的高分辨率结构均未被解析,一定程度上限制了对 Claudin 18 的功能认知和药物开发。
Claudin 18.2 与胃癌治疗潜力
2008年,德国科学家 Ugur Sahin和 Ganymed 团队在《Clinical Cancer Research》发表研究论文,对大量的基因表达序列标签(ESTs)数据库进行了数据分析,尤其是来自胃组织的数据。通过一系列生物信息学分析和实验验证,确定了 Claudin 18.2 是胃癌中新发现的治疗靶点,它在显著比例的原发性胃癌及其转移灶中表达。

通过肌肉注射含编码 Claudin 18.2 首个细胞外结构域融合蛋白的质粒DNA,对 BALB/c 小鼠进行三次免疫接种,并辅以聚乙烯亚胺助剂增强免疫效果。随后采用表达全长 Claudin 18.2 的HEK293 细胞强化免疫应答。完成免疫后,从小鼠脾脏中获取淋巴细胞与骨髓瘤细胞进行融合,形成能分泌抗 Claudin 18.2 抗体的杂交瘤细胞株,最终筛选得到针对CLDN18.2的鼠源单克隆抗体。
通过研究人员成功制备的 Claudin 18.2 的单克隆抗体,这些抗体能够特异性识别该分子而不与肺特异性剪接变体 Claudin 18.1 结合,并能够在癌细胞表面识别抗原。进一步的调控机制研究确认了 Claudin 18.2 在临床样本中的分布特征及其作为潜在治疗靶标的可行性。
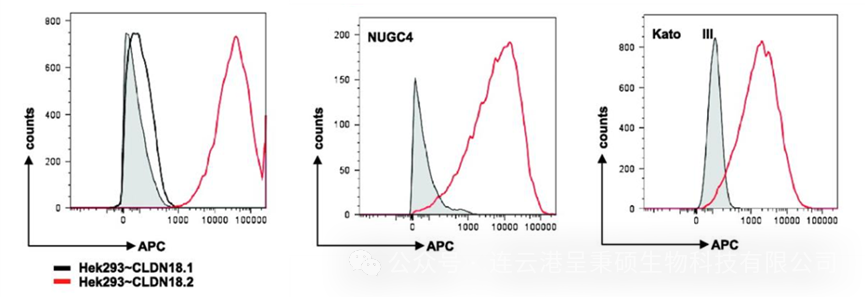
(来源于 DOI: 10.1158/1078-0432.CCR-08-1547)
近年来,Claudin 18.2 在胃癌研究和治疗潜力中越来越引人关注。因为 Claudin 18.2 局限于胃部正常组织中的分化上皮细胞,在胃癌及其转移灶中持续表达,并可见于其他多种相关肿瘤中。Claudin 18.2 对于调控胃上皮细胞分化及阻止胃酸跨细胞泄漏具有重要作用。此外,Claudin 18.2 在胃癌中表达水平、分布及其与细胞内信号通路、临床病理因素以及预后之间的关系已得到深入研究,尤其是抗 Claudin 18.2 单克隆抗体 Zolbetuximab 在诊断恶性肿瘤和治疗胃癌方面的潜在价值备受瞩目。Claudin 18.2 成为癌症治疗的重要靶标之一,其针对性抗体在胃癌等癌症治疗领域展现出巨大潜力。
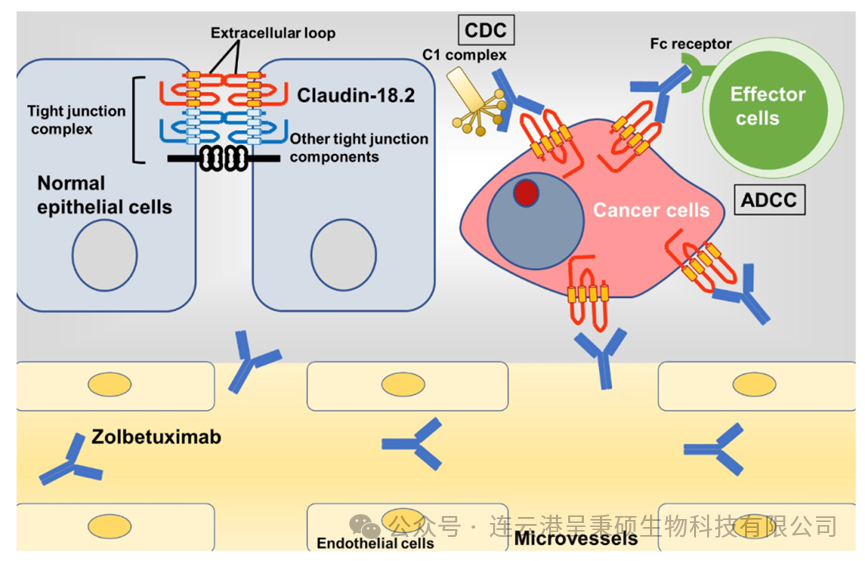
(来源于 DOI: 10.1080/21688370.2021.1967080)
Claudin 18.2 的首款治疗药物开发
在1990年代至2000年初,Ugur Sahin 博士在德国和瑞士的大学中积累了丰富的肿瘤学研究经验,并深刻认识到传统癌症治疗手段如化疗和放疗对患者生存率的局限性。他在寻求与大型药企合作的过程中意识到商业策略往往会影响科研项目的进展。基于这一认识,以及对改变癌症治疗格局的决心,他在2001年创立了 Ganymed Pharmaceuticals,专注于开发针对癌症的高度靶向免疫疗法。
2006 年,Ganymed团队首次提交了一项题为“靶向 Claudin-18 的单克隆抗体用于治疗癌症” 的专利(EP1948693B1)。多款特异性靶向 Claudin 18.2 的抗克隆抗体均表现出较好的肿瘤杀伤效果。这也是前文提及的能够选择性结合 Claudin 18.2 而不结合 Claudin 18.1 的单克隆抗体产品。
(来源于专利 EP1948693B1)
2009年,基于Ganymed 公司启动了首个针对 Claudin-18.2 抗体的临床试验,设计该抗体通过抗体依赖性细胞介导的细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)机制来杀灭癌细胞。这项 I 期研究 (NCT00909025) 旨在确定单次输注 Claudiximab 单抗对复发性晚期胃食管癌和胃腺癌患者的安全性、毒性和最大耐受剂量。当时这款名为 Claudiximab 或 IMAB-362 的抗体后来被重新命名为 Zolbetuximab。
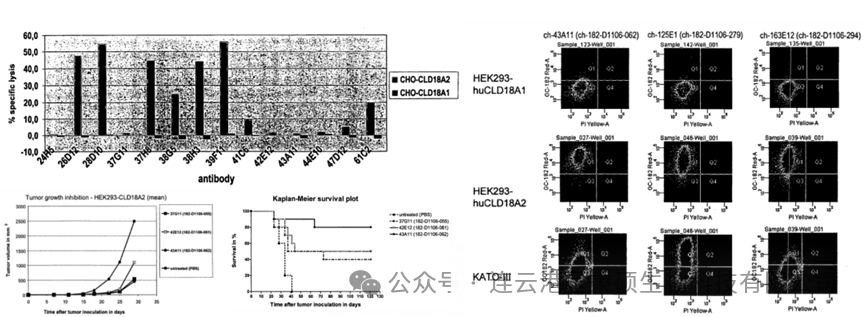
相关临床1期数据于2018年发表于《Eur J Cancer》杂志,该研究纳入15名成年患者,采用 3+3 设计,分为五个剂量递增队列(33, 100, 300, 600, 1000 mg/m²)。结果显示,IMAB-362 在所有剂量下总体耐受性良好,主要副作用为胃肠道毒性。药物动力学数据显示,IMAB-362 的血药浓度随剂量增加呈比例增长,半衰期在13至24天之间。下图为 IMAB-362 在不同条件下的杀伤肿瘤细胞效果以及患者的免疫应答能力。
(来源于 DOI: 10.1016/j.ejca.2018.05.007)
2010年-2012,Ganymed 公司相继启动多项临床1期和2期研究,进一步评估多剂量 IMAB-362 作为单药治疗胃或食道下段转移性、难治性或复发性腺癌等不同患者群体的疗效和安全性。
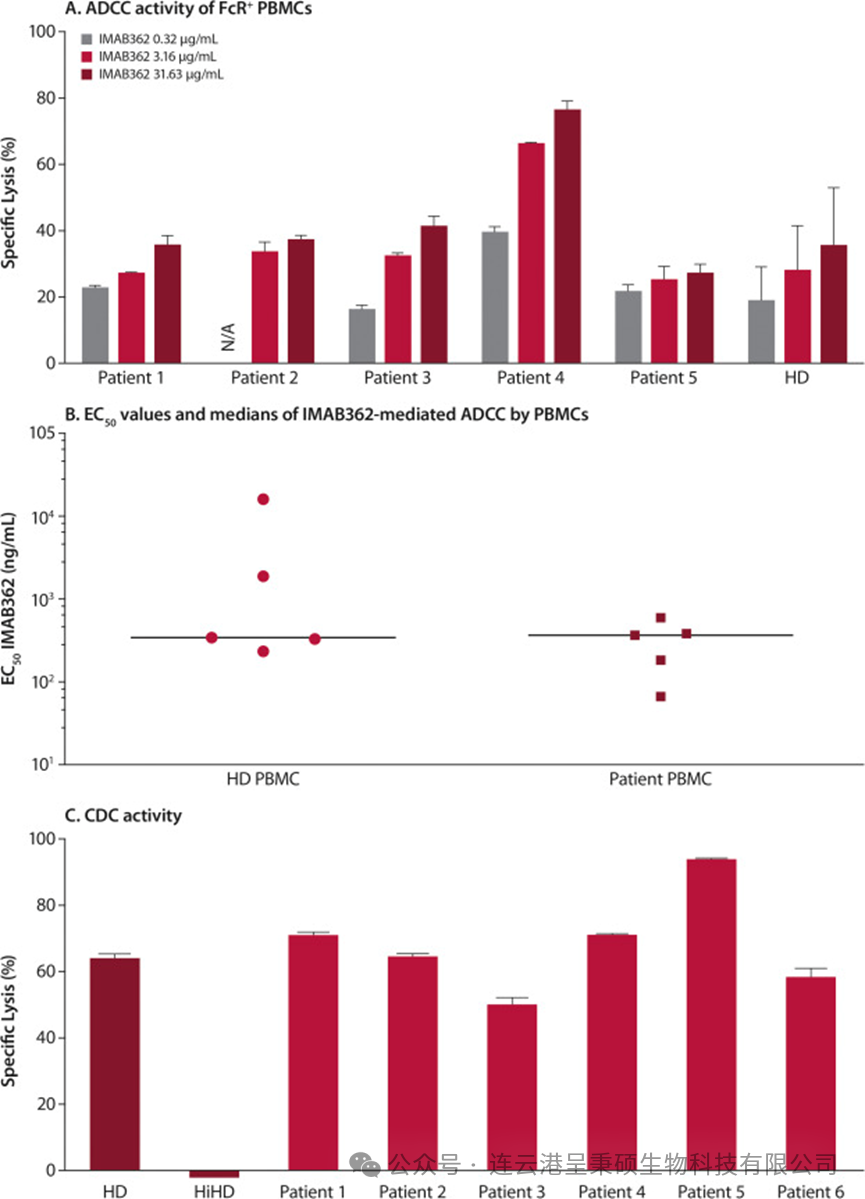
根据一份 Ganymed 公司 2014 年发表关于 IMAB-362 潜在治疗的体外可行性研究研究报告, 103 份(59.2%)原发性胰腺导管腺癌组织样本 Claudin 18.2 呈阳性,绝大多数阳性样本高度表达 Claudin 18.2。这种表达不仅限于原发肿瘤,在转移后也会保持。因此,相当多的胰腺肿瘤患者原则上符合 Claudin 18.2 靶向治疗的条件。下图为 IMAB-362 在不同条件下的杀伤肿瘤细胞效果以及患者的免疫应答能力。
在原发性胰腺肿瘤中的表达 (来源于DOI: 10.1002/ijc.28400)
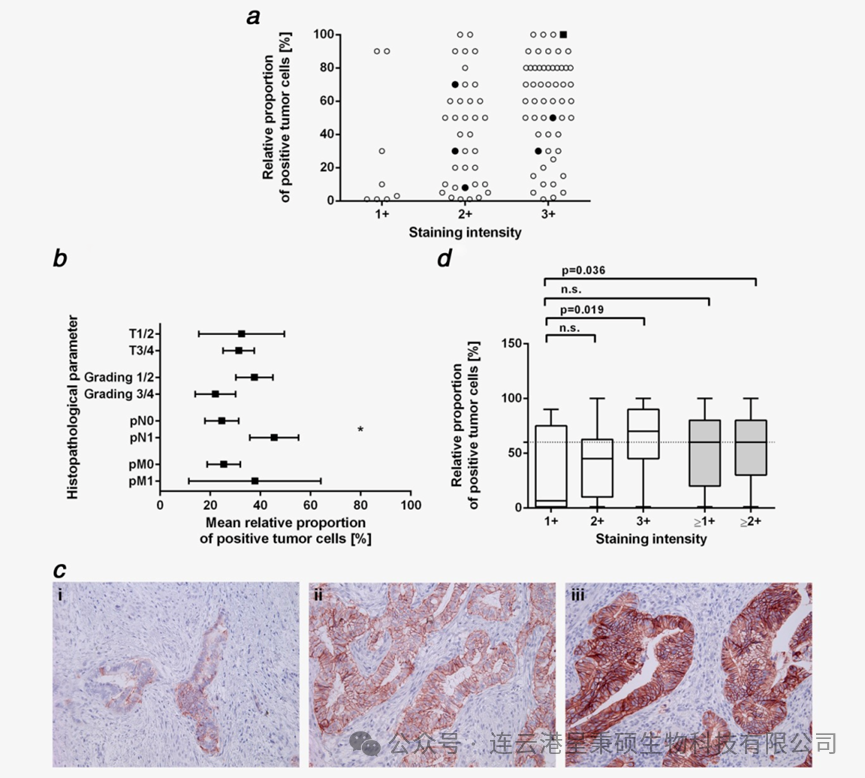
在 2016 年美国临床肿瘤学会年会上,Ganymed 公司首次公布了一项关于 IMAB-362 单克隆抗体在胃癌一线治疗中令人瞩目的 II 期临床试验数据。该研究纳入了晚期、生物标志物阳性的胃癌患者,并成功达到了所有预设终点。关键结果显示,当将 IMAB-362 与标准化疗方案联合使用时,显著延长了患者的中位总生存期(13.2个月 vs. 8.4个月)。尤其在 Claudin 18.2 表达水平最高的患者中,其获益更为明显,中位总生存期达到16.7个月,而仅接受化疗组为9.0个月。在整个研究过程中,IMAB-362显示出良好的耐受性,最常见的不良反应包括恶心、呕吐和中性粒细胞减少症。
2016年,Astellas制药公司宣布以 4.22 亿欧元的价格收购了Ganymed 100%的股权。此外,基于 Ganymed 最先进临床项目 IMAB-362 的研发进展,其股东将有资格获得最高达 8.6 亿欧元的额外支付款。随着后期临床研究的发展,进一步验证了 IMAB-362 在胃癌治疗中的活性,表明其具有一定的疗效潜力,为胃癌患者提供了新的治疗选择。
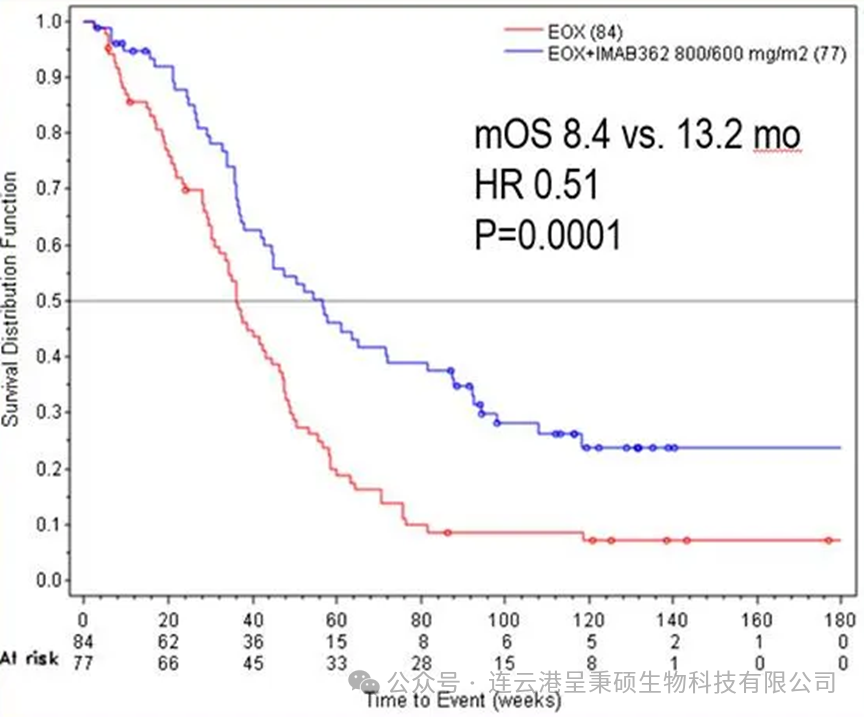
2021年 Astellas 制药公司根据随后公布关于 IMAB-362 的 FAST 临床2期针对晚期胃、食管胃交界及食管腺癌患者的研究数据,Zolbetuximab (IMAB-362) 与一线 EOX 方案(epirubicin + oxaliplatin + capecitabine)联合使用的疗效和安全性。结果显示,在总体人群中,相比单独 EOX 治疗,Zolbetuximab + EOX 显著改善了无进展生存期(PFS)和总生存期(OS)。在 Claudin18.2 中至强表达≥70%的肿瘤细胞亚群中,PFS 优势尤为明显。Zolbetuximab + EOX方案耐受性良好,主要不良事件(恶心、呕吐、中性粒细胞减少、贫血)多为1-2级,整体并无显著增加3级及以上不良事件。基于这些结果,Zolbetuximab 800/600 mg/m²剂量已进入III期临床试验。
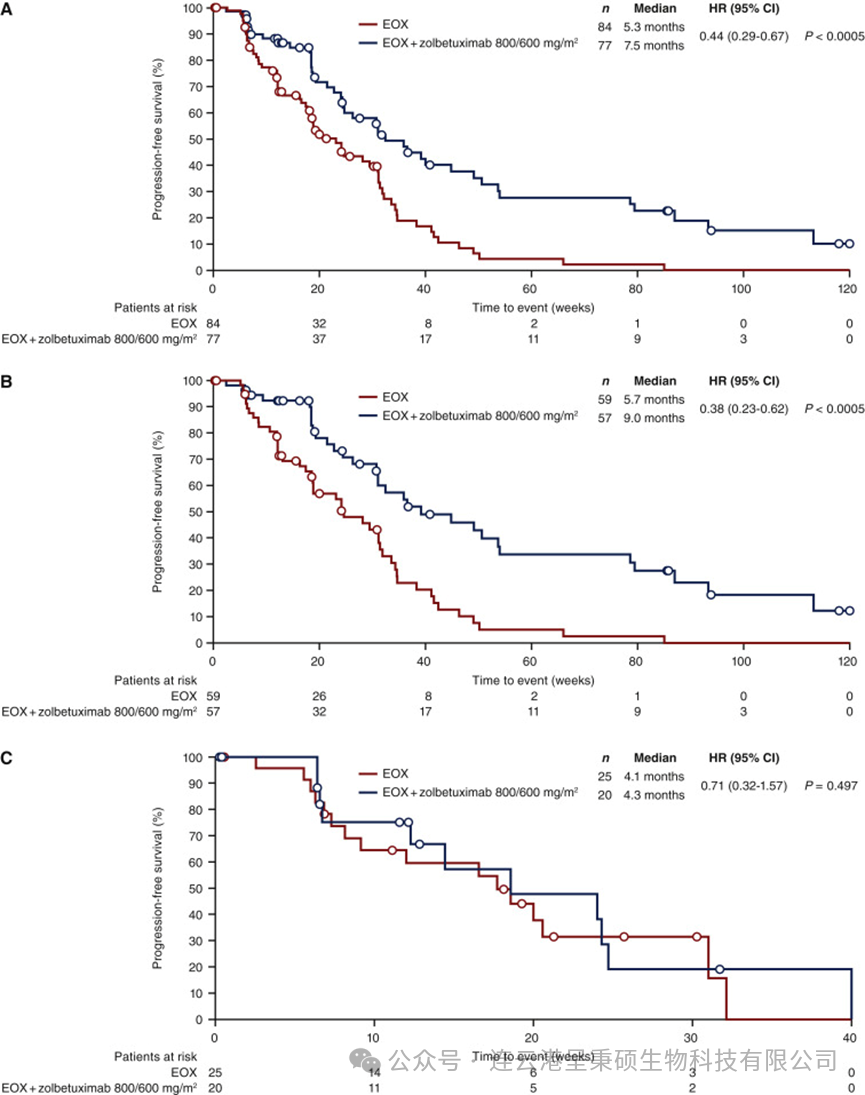
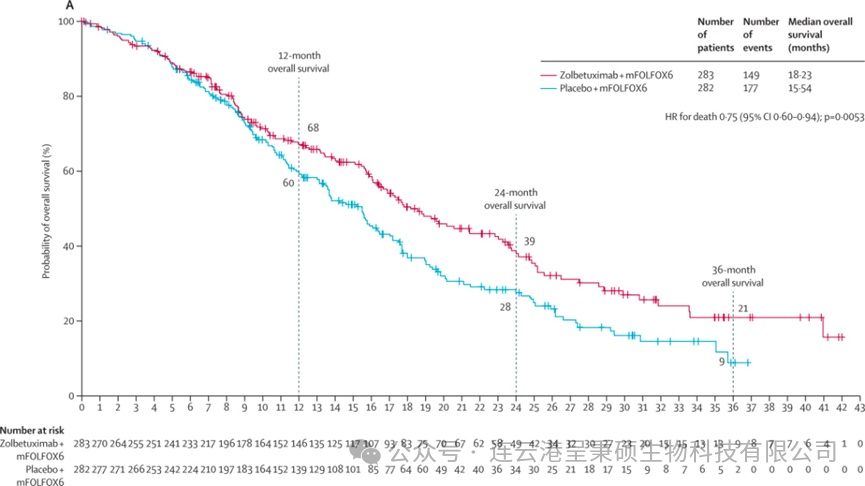
2023年5月,Astellas 制药公司在知名杂志《柳叶刀》发表研究论文公布 SPOTLIGHT III期临床试验结果。这是一项全球性、随机、双盲、III期临床试验,研究了在 Claudin18.2 阳性、HER2阴性的局部晚期不可切除或转移性胃或食管胃交界腺癌患者中,一线治疗方案 Zolbetuximab 联合 mFOLFOX6 化疗对比安慰剂 + mFOLFOX6 化疗的效果与安全性。结果显示,在符合条件的565名患者中,接受 Zolbetuximab + mFOLFOX6 治疗组相较于安慰剂组显著降低了疾病进展或死亡风险,中位无进展生存期延长至10.61个月,优于安慰剂组的8.67个月;同时总生存期也显著改善。
美国食品药品监督管理局针对 Zolbetuximab 用于治疗 Claudin 18.2 阳性、局部晚期不可切除或转移性、HER2阴性的胃或食管胃交界腺癌患者,发布了一份完整回复函,拒绝了该药物生物制品许可申请。Astellas 的最新新闻稿指出,FDA 拒绝原因是第三方生产工厂在预批准检查中存在不足之处。因 FDA 并未要求提供额外的临床数据或研究来验证该药物的有效性和安全性。目前,研发方正与 FDA 及第三方制造商紧密合作,以解决检查中发现的问题。
Claudin 18.2新药研发现状
23 年 7 月,《自然》杂志撰文 “Claudin-18.2 attracts the cancer crowd”,介绍了目前领域对 Claudin 18.2 等热门靶点的大规模投资带来了一系列研发进展。靶向 Claudin18.2 的策略有多种,包括单克隆抗体、双特异性抗体、CAR-T 和 ADC,将有机会整体提高癌症患者的生存率,降低全球癌症负担。
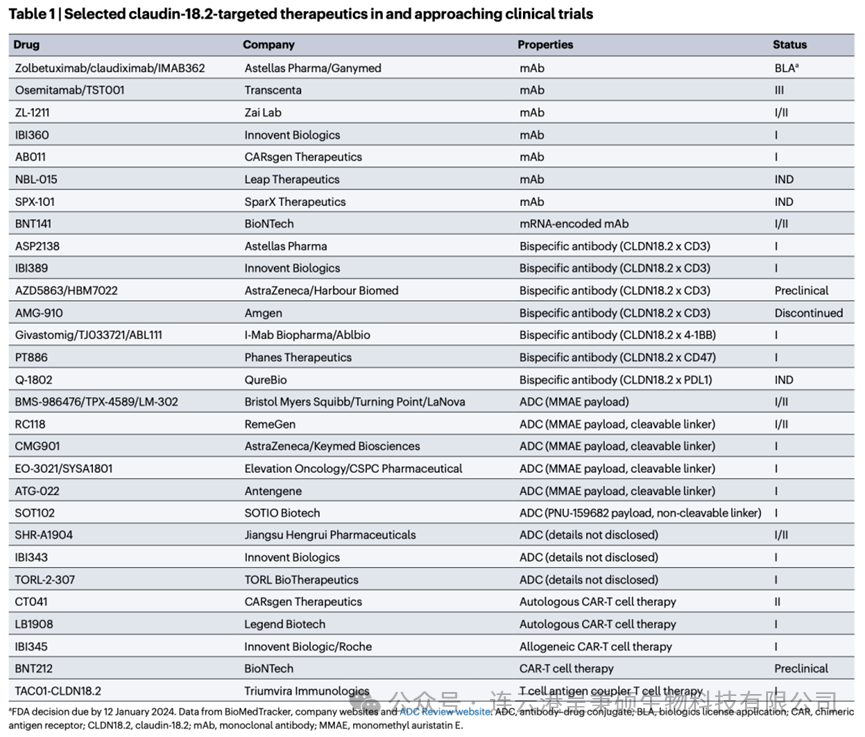
根据智慧芽新药情报库统计,目前全球靶向 Claudin 18.2 的新药研发管线合计130+,其中 Astellas 公司的单抗产品 Zolbetuximab 暂时领先,处于申请上市阶段。4 款药物处于临床3期研究阶段,4款药物处于临床2期研究阶段,另有45项处于临床1或1/2期。
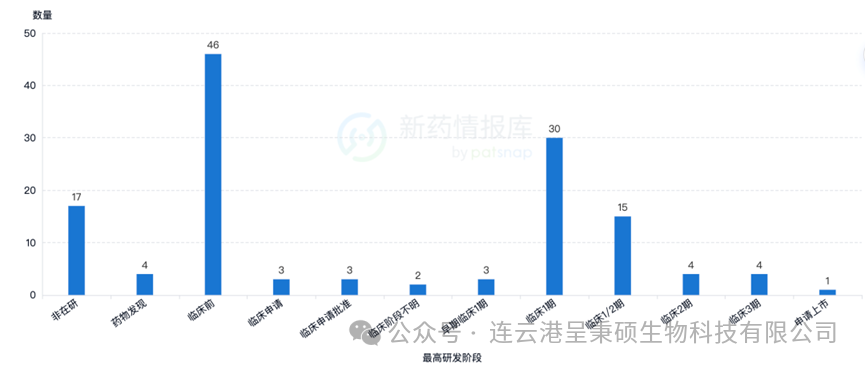
除主要管线以单 Claudin 18.2 为治疗靶点外,Claudin 18.2 结合多种热门抗肿瘤靶点,如CD3、PD-L1、4-1BB、管突蛋白、CD47、CD19、CXCR4 等,成为创新产品开发的新方向。例如,ASP2138 是 Astellas 公司正在开发的一款同时靶向 Claudin 18.2 和 CD3 的双特异性抗体产品。
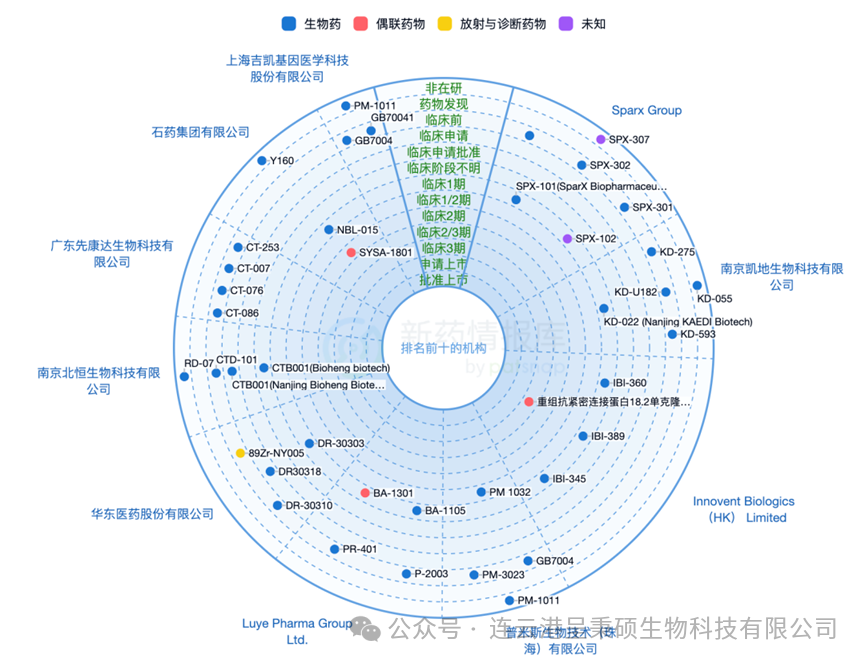
中国目前是全球 Claudin 18.2 药物研发的热门地区,约 70% 的研发管线有中国生物技术公司或药企开发,开发进度领先的企业包括江苏奥赛康药业、信达生物、明济生物、苏州胜创、康诺亚、礼新医药、科济生物、石药集体等。热门适应症包括胃癌、胰腺癌、Claudin 18.2 阳性实体瘤等。
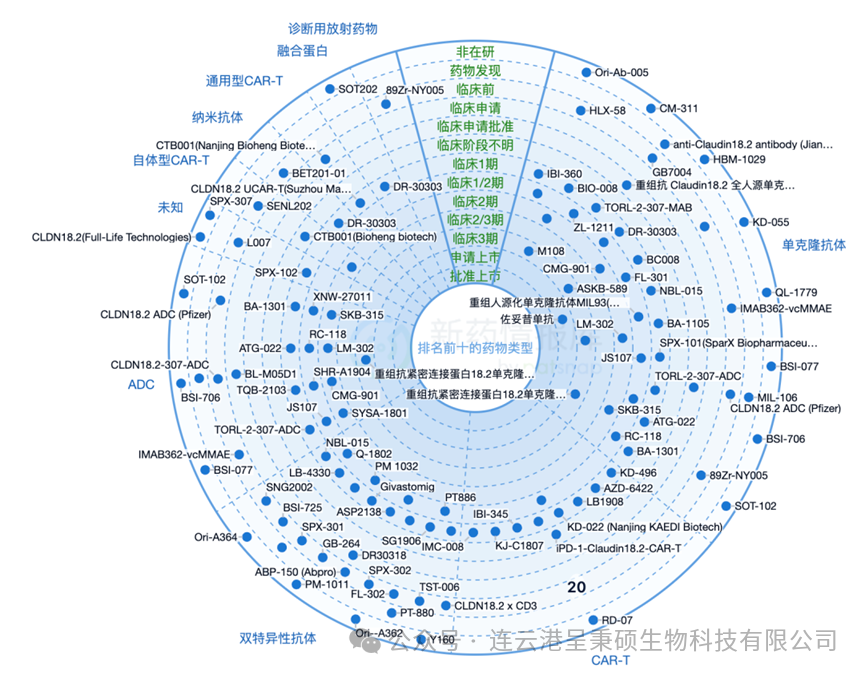
药物类型方面,以单克隆抗体产品和 CAR-T 产品为主,另有双特异性抗体、ADC 产品、纳米抗体产品、融合蛋白等生物药类型多样。
继 Astellas 公司 Zolbetuximab 在中国开展临床研究之后,中国企业苏州胜创、江苏奥赛康药业、信达生物、明济生物等企业也相继获批开展临床3期研究实验。
Osemitamab(TST001)是创胜集团开发的一款靶向 Claudin 18.2 的单克隆抗体产品。据悉,Osemitamab 是第二代靶向 Claudin 18.2 的人源化抗体,具有改善的Claudin 18.2 结合亲和力和增强的抗体依赖性细胞毒性,其在具有广泛 CLDN18.2 表达的临床前肿瘤模型中显示出抗肿瘤活性。23年10月,美国 FDA 批准创胜集团开展Osemitamab 作为胃癌或胃食管结合部腺癌患者的一线治疗的全球III期试验。23年12月,创胜集团发布公告称,[177Lu] Lu标记的抗 Claudin 18.2 抗体 Osemitamab 在胃癌小鼠异种移植模型中展现出放射免疫治疗潜力。
M108 单抗注射液是明济生物自主研发的针对靶点 Claudin 18.2 肿瘤抗原高表达的 ADCC 增强型单克隆抗体,通过增强型的 ADCC 效应充分调动患者机体的免疫细胞来杀伤肿瘤细胞。23年12月底,明济生物在 Clinicaltrials.gov 平台上注册了 M108 的III期临床试验。目的是探索 M108 单克隆抗体加化疗与安慰剂加化疗作为 Claudin 18.2 阳性、HER2 阴性、PD-L1 CPS<5、局部晚期或转移性胃/腺癌的一线治疗的疗效和安全性。
IBI343 是信达生物原研开发的一款重组人源抗 Claudin 18.2 的 ADC 产品,与表达Claudin 18.2 的肿瘤细胞结合后,可发生 Claudin 18.2 依赖性 ADC 内化,并释放毒素药物引起 DNA 损伤,导致肿瘤细胞凋亡。游离的毒素药物也可以通过质膜扩散到达并杀死相邻的肿瘤细胞,因此IBI343也具有旁观者效应。近期,信达生物在 Clinicaltrials.gov平台上注册了 IBI343 的III期临床试验。
ASKB589 是江苏奥赛康原研开发的一款 ADCC 增强型第二代抗 Claudin 18.2 单抗,在分子设计和细胞株构建上采用去岩藻糖技术,对 Claudin 18.2 的亲和力和特异性更高,转化为更强的抗体依赖细胞介导毒作用。1月底,奥赛康发布公告称ASKB589 用于一线晚期胃癌治疗的注册性临床III期研究已完成中国首例患者给药,标志着国际范围内首个针对胃癌及食管胃交界处腺癌患者一线治疗的三联疗法(抗Claudin 18.2 抗体联合化疗及PD-1抑制剂)的注册性临床研究全面启动。
由于Claudin18.2的复杂性和特殊性质,其提取和纯化过程异常艰难,导致相关基础研究成本高昂,成为科研工作者的一大障碍。呈秉硕生物凭借其在无细胞蛋白表达平台的独有技术和重组蛋白表达纯化的丰富经验,成功表达了全长的 Claudin18.2 蛋白,并且向全球范围内推广。
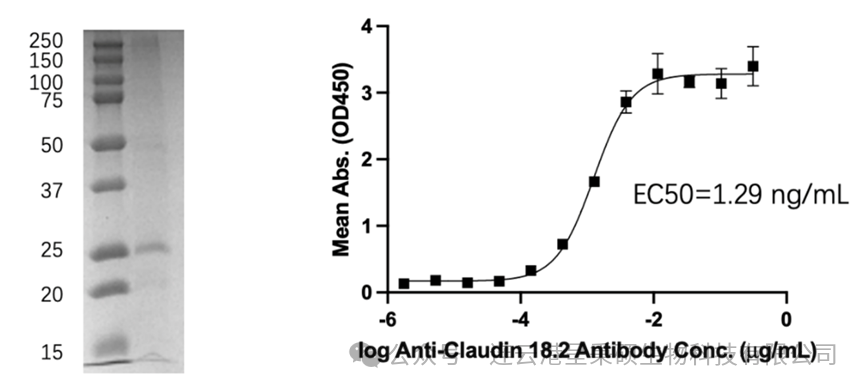
(来源于秉硕生物 http://www.cellfree.cn/sy)
这是无细胞技术平台对国内生物医药研发的一次巨大助力。呈秉硕生物正式将 Claudin 18.2 这种关键蛋白通过无细胞蛋白表达平台提高开发蛋白的研发效率,并且大幅度降低了该蛋白的生产制造成本。这一举措,无疑将为国内外 Claudin 18.2 相关的生物医药研发注入新的活力,让更多的研究机构和实验室能够负担得起这一重要资源,从而加速相关药物的研发进程。
随着 Zolbetuximab 临床研究陆续获得成功、多种不同的药物类型相继被开发并获得临床验证、以及 Claudin18.2 蛋白价格的大幅降低,我们有理由相信,国内医药在相关领域的基础研究将迎来一个新的春天,新的药物、新的治疗方案将会更快地走向市场,造福于人类健康。
呈秉硕生物将聚焦于基于无细胞技术平台的技术迭代,充分利用好无细胞技术平台提升研发效率,同时快速降低生产制造成本,为更多复杂的生物材料的研发,以及生产制造提供新工具,新方法,把不可能变为可能,更好的促进生命科学行业的进步。
感谢 GPCR drug discovery作者为本文提供的内容整理编辑!














