蛋白质合成的新策略——无细胞体系
蛋白质的表达纯化是生物学实验中的常见研究手段之一,在之前的文章中我曾试图描述与蛋白质相关的生物学框架,而这一生物学框架上对蛋白质结构与功能细节的研究,往往都离不开蛋白质的表达:
传统的蛋白质表达技术往往使用活细胞系统,包括原核细胞系统(如大肠杆菌、链霉菌、枯草芽孢杆菌等)和真核细胞系统(昆虫、酵母、哺乳动物细胞),得益于成熟的细胞培养技术和转基因技术(转入蛋白表达载体),这些基于活细胞的表达系统在蛋白质纯化中已经广泛应用。
使用活细胞表达系统的优势是活细胞的蛋白质折叠与定位环境,从而表达出尽可能“真实”的蛋白;同时,活细胞具有完善的遗传信息和细胞的扩增体系,可以“无限续杯”第一次转化后产生的表达菌株。然而,由于活细胞存在复制和扩增的“生理需要”,从而使得活细胞的“精力”有很大一部分被用于自身的繁殖和扩增,从而使得其蛋白的表达量受限。此外,尽管活细胞能够尽可能的模拟天然蛋白质的折叠和定位环境,但蛋白质纯化的技术的限制使得其需要在较为“激烈”的手段下才能“脱离”原位,这一过程可能会破坏蛋白质的构象。
那么,能否将细胞破壁的过程挪到目标蛋白质表达之前呢?
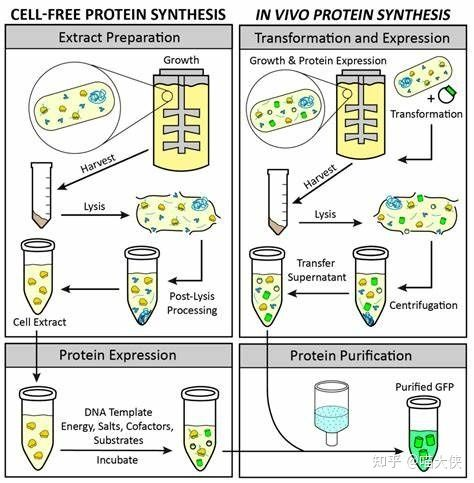
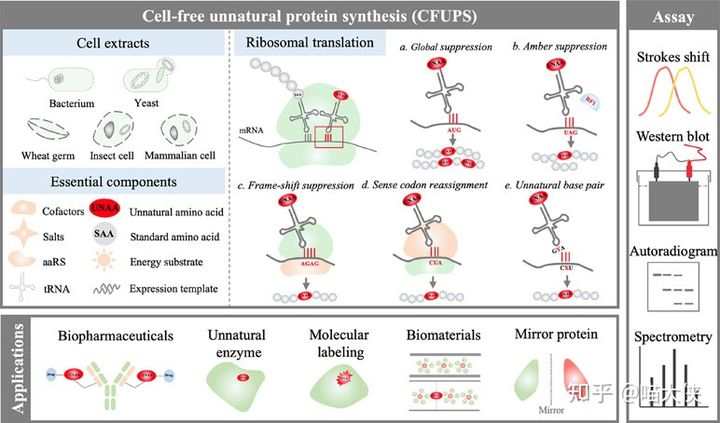
除了活细胞表达系统以外,无细胞系统[1]也可以被用于蛋白质的表达,其技术原理是先培养“野生型”的细胞到一定生物量以后,如上图[2]所示破碎野生型细胞得到无细胞体系(也可以直接使用纯化的各种翻译元件和分子伴侣,如下图[3]),根据不同的需要,可以在产品化的无细胞体系中加入不同的辅助因子和负责编码蛋白的“表达载体”,从而可以控制无细胞体系表达目的蛋白——由于失去了复制自身的能力,无细胞体系相比同等生物量的活细胞体系可以表达更多的目的蛋白。同时由于细胞结构的破坏,无细胞体系的蛋白纯化相较于活细胞体系更为简单柔和,可用于难表达的水溶性蛋白和膜蛋白的表达。比如,表达毒性蛋白和活细胞内无法大量表达的其他蛋白,高通量表达膜蛋白等,是适用无细胞体系的理想场景。
此外,无细胞体系还可以加入一些辅助因子帮助目标蛋白的折叠,这是活细胞体系中无法做到的,比如加入去垢剂或脂质体,从而辅助膜蛋白折叠(如下图)。

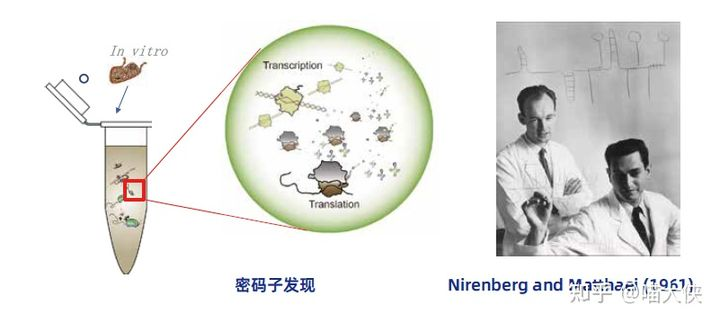
其实,无细胞蛋白质表达并非一项“新”技术,早在1961年Nirenberg等人鉴定密码子的时候,就已经使用到了无细胞的蛋白表达技术。然而,由于早期无细胞技术的局限性,其技术发展的速度较为缓慢,产业化程度较低。即使如此,早在本世纪初,无细胞体系也已经开始被用于各种蛋白质的生产。
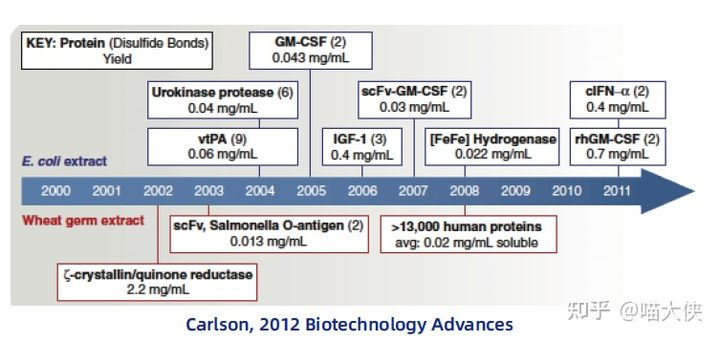
理论上可以使用来自于任何物种悬浮细胞的生物质来制备无细胞体系,这也就为其创造了多种多样的理论上的提取物来源,市面上也已经有多种大肠杆菌和酵母的的无细胞表达试剂盒,包括S12, S30, S60, S100, S150, A19, D10, BL21, Rosetta等。这些试剂盒可以直接用于无细胞体系的蛋白质表达,从而节省了“感受态-转化-细胞培养-破壁”的活细胞体系的实验操作。
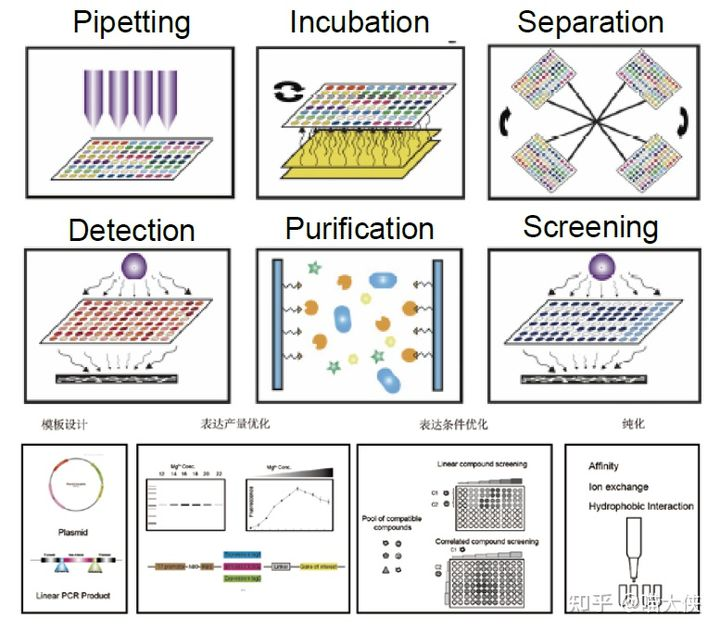
相较于“非均质”的活细胞系统,“均质”的无细胞系统更加适用于高通量的表达条件筛选,因此可以用于大规模的蛋白质表达纯化条件筛选,国内也有公司开展了此项业务。
使用无细胞系统,也可以表达在序列中插入非天然氨基酸的蛋白质——相较于制作包含一整套非天然氨基酸翻译体系的菌种,利用无细胞体系混入更多翻译过程中的元件,是更为简单的做法[4]。
参考
1.^题图 http://2017.igem.org/Team:Hong_Kong-CUHK/Description
2.^https://medium.com/@macromoltek/cell-free-protein-synthesis-9bbe08a1ae17
3.^H. Jia et al. / New Biotechnology 39 (2017) 199–205 https://www.sciencedirect.com/science/article/pii/S1871678416325031
4.^Front. Pharmacol., 29 May 2019 https://www.frontiersin.org/articles/10.3389/fphar.2019.00611/full
以上文章不足之处,欢迎大家指正。(如有转载,请注明联系电话18834858666和微信联系方式)














